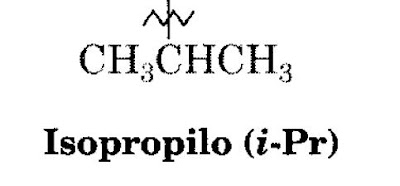Los nombres de los alcanos de cadena recta se asignan de acuerdo con la cantidad de átomos de carbono en la cadena con excepción de los primeros cuatro compuestos (metano, etano, propano y butano), cuyos nombres tienen raíces históricas, los nombres de los alcanos se basan en números en griego. Se agrega el sufijo ano a la terminación de cada nombre para indicar que la molécula es de un alcano.
Grupos alquiloAl eliminar un átomo de hidrógeno a un alcano, la estructura parcial que queda se llama grupo alquilo. Los grupo alquilo no son compuestos estables por ellos mismo, sino partes de compuestos mayores. Los nombres de los grupos se forman cambiando la terminación ano del alcano primitivo, por la terminación ilo. Un grupo alquilo es el radical que queda después de quitar uno de los hidrógenos del correspondiente alcano.

Se observa que los radicales iso son formados por una cadena lineal que remata en un carbono (secundario) con dos radicales metilo. Asimismo, los radicales neo son cadenas lineales que rematan en un carbono terciario con tres grupos metilo. La asignación sec se aplica a aquellos grupos alquilos que están ligados a la cadena principal por el segundo carbono.
Nomenclatura de Alcanos ramificados.
El sistema de nomenclatura que se estudiara fue ideado por la Unión Internacional de Química Pura y Aplicada (IUPAC: International Union of Pure and Applied Chemistry).
Un nombre de sustancia orgánica tiene tres partes en este sistema: prefijo, sustancia principal y sufijo. El prefijo se refiere a los lugares de los grupos funcionales y demás sustituyentes en la sustancia principal. La sustancia principal indica una parte central de la molécula y dice cuántos átomos hay en ella; el sufijo identifica la familia de grupo funcional al que pertenece la molécula.
PREFIJO – SUSTANCIA PRINCIPAL - SUFIJO
(¿Dónde están los sustituyentes?) – (¿Cuántos Carbonos?) – ( ¿Qué familia?)
Es posible denominar los alcanos de cadena ramificada, excepto los más complicados, siguiendo cuatro pasos; se necesita otro más para unos cuantos compuestos.
Paso 1. Determinar cuál es el hidrocarburo principal.(a) Hallar la cadena continua más larga de átomos de carbono presente en la molécula y usar el nombre de esa cadena como el nombre de la sustancia principal. Puede ser que la cadena más larga no sea evidente, por la manera en que está escrita, por lo que quizá haya que “dar vueltas en la trayectoria”

(b) Si hay dos cadenas distintas con igual longitud, se toma como sustancia principal la que tenga mayor cantidad de puntos de ramificación.

Paso 2. Numerar los átomos de la cadena principal.
(a) Se numera cada átomo de carbono en la cadena de la sustancia principal a partir del extremo más cercano al
punto de ramificación.

La primera ramicificacion esta en C3, cuando el sistema de numeración es el correcto, no el c4.
(b) Si hay ramificaciones a distancias iguales de ambos extremos de la cadena de la sustancia principal, la numeración comienza en el extremo más cercano al segundo punto de ramificación:
Paso 3. Identificar y numerar a los sustituyentes
(a) Se asigna un número a cada sustituyente, de acuerdo con su punto de fijación a la cadena principal.
(b) Si hay dos sustituyentes en el mismo carbono, se les asigna el mismo número. Debe haber tantos números en el nombre como sustituyentes haya en la molécula.

Paso 4: Escribir el nombre en una sola palabra.
Se usan guiones para separar los distintos prefijos y comas para separar los números. Si hay dos o más sustituyentes idénticos, se usa uno de los prefijos multiplicadores di, tri, tetra, etc. Sin embargo, no se deben emplear para fines de alfabetización.
En algunos casos se hace necesario un quinto paso. A veces sucede que un sustituyente de la cadena principal tienen subramificaciones:
Para dar el nombre completo del compuesto hay que denominar primero al sustituyente.
Paso 5: Denominar al sustituyente complejo como si fuera un compuesto.
Se comienza a numerar en el punto de fijación a la cadena principal, y así se ve que el sustituyente complejo es un grupo (ejemplo). Para evitar confusiones se anota el nombre del sustituyente en orden alfabético entre paréntesis (incluyendo cualquier prefijo numérico), en el nombre de la molécula completa:

Por razones históricas, a algunos de estos grupos alquilo más simples y de cadena ramificada tienen nombre no sistemáticos, o comunes, como se dijo antes.
1. El grupo alquilo con tres carbonos:
2. Los grupos alquilo con cuatro carbonos:
3. Los grupos alquilo con cinco carbonos:
Los nombres comunes de estos grupos alquilo simples están tan enraizados en las publicaciones químicas que la IUPAC los permite. No hay sino que memorizar esos nombres comunes; por fortuna no son muchos.
Fuente: Quimica Orgánica de McMurry
 Otro efecto interesante que hay en los alcanos es que a mayor ramificación, más bajo resulta el punto de ebullición. Los alcano ramificados tienen un punto de ebullición más bajo porque son más esféricos que los alcanos de cadena recta, tienen menores áreas superficiales y, en consecuencia, menores fuerzas de van der Waals.
Otro efecto interesante que hay en los alcanos es que a mayor ramificación, más bajo resulta el punto de ebullición. Los alcano ramificados tienen un punto de ebullición más bajo porque son más esféricos que los alcanos de cadena recta, tienen menores áreas superficiales y, en consecuencia, menores fuerzas de van der Waals.